
2020年07月18日訊 /生物谷BIOON/ --禮來(Eli Lilly)近日公布了新型抗炎藥mirikizumab治療中重度斑塊型銀屑病III期OASIS-2研究的陽性結(jié)果。結(jié)果顯示,與安慰劑相比,mirikizumab在第16周(優(yōu)越性)達(dá)到了主要終點和全部關(guān)鍵次要終點。此外,與諾華抗炎藥Cosentyx(中文商品名:可善挺,通用名:secukinumab,司庫奇尤單抗,俗稱“蘇金單抗”)相比,mirikizumab在第16周(非劣效性)和第52周(優(yōu)越性)達(dá)到了全部關(guān)鍵次要終點,包括第52周皮損完全清除方面的優(yōu)越性。
mirikizumab是一種人源化IgG4單克隆抗體,靶向結(jié)合IL-23的p19亞基,該藥目前正開發(fā)用于多種免疫性疾病,包括斑塊型銀屑病、潰瘍性結(jié)腸炎及克羅恩病等。
禮來生物醫(yī)藥公司高級副總裁兼總裁Patrik Jonsson表示:“這項研究的結(jié)果對全世界銀屑病患者來說是非常有希望的。我們期待著將mirikizumab推向市場,為患者提供一種額外的治療方案,該方案有潛力提供皮損完全清除或幾乎完全清除(根據(jù)PASI 90和PASI 100衡量)的療效,且在52周期間具有持續(xù)的效果。”
OASIS-2是一項多中心、隨機、雙盲、安慰劑對照III期研究,比較了mirikizumab、安慰劑、Cosentyx治療中重度斑塊型銀屑病患者的療效和安全性。該研究中,1465例患者以4:4:4:1的比例隨機分成以下誘導(dǎo)期和維持期治療:(a)mirikizumab治療組1:第0、4、8、12周分別給藥一次(250mg),從第16周開始每8周一次(Q8W,250mg);(b)mirikizumab治療組2:第0、4、8、12周分別給藥一次(劑量250mg),從第16周開始Q8W 125mg劑量;(c)Cosentyx治療組:第0、1、2、3、4周分別給藥一次(300mg),從第4周開始每4周一次(Q4W,300mg);(d)安慰劑組:第0、4、8、12周分別給予一次安慰劑,第16-32周每4周給藥一次mirikizumab(Q4W,250mg),之后每8周一次mirikizumab(Q8W,250mg)。所有治療均通過皮下注射給藥。
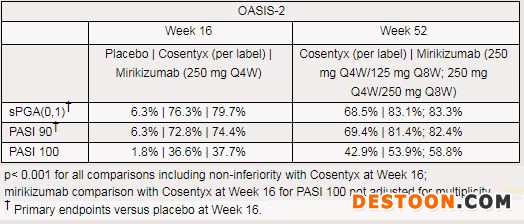
該研究中,主要終點包括:治療第16周,與安慰劑相比,靜態(tài)醫(yī)生總體評估(sPGA)評分為(0,1)且至少改善2分的患者比例、銀屑病面積和嚴(yán)重程度指數(shù)(PASI)較基線至少改善90%(PASI 90)的患者比例。與Cosentyx比較,在第16周評估相似終點作為關(guān)鍵次要終點。其他次要終點包括:治療第16周,與安慰劑相比,銀屑病面積和嚴(yán)重程度指數(shù)(PASI)較基線至少改善75%(PASI 75)和100%(PASI 100)的患者比例。與Cosentyx比較,第52周的關(guān)鍵次要終點包括sPGA評分為(0,1)且至少改善2分的患者比例,以及PASI較基線改善至少90%(PASI 90)和100%(PASI 100)的患者比例。
結(jié)果顯示,研究達(dá)到了主要終點和全部關(guān)鍵次要終點,所有對比的統(tǒng)計學(xué)分析均p<0.001,包括治療第16周相比Cosentyx的非劣效性。具體療效數(shù)據(jù)如下所示。
該研究中,安全性分析結(jié)果與先前披露的mirikizumab結(jié)果和IL23 p19類別其他藥物的已知安全性結(jié)果一致。誘導(dǎo)期(至16周)最常見的治療不良事件(≥5%)為鼻咽炎和上呼吸道感染,誘導(dǎo)期+維持期(至52周)為鼻咽炎、上呼吸道感染、頭痛、背痛和關(guān)節(jié)痛。在誘導(dǎo)期(<2.5%)和誘導(dǎo)期+維持期(長達(dá)52周)(<6%)各治療組的嚴(yán)重不良事件發(fā)生率具有可比性。
OASIS-2研究的完整結(jié)果將在未來召開的醫(yī)學(xué)會議上公布。mirikizumab治療炎癥性腸?。↖BD)包括潰瘍性結(jié)腸炎(UC)和克羅恩?。–D)的III期臨床試驗正在進(jìn)行中,這一領(lǐng)域的治療選擇有限,患者目前的服務(wù)不足。在由于COVID-19大流行而暫停入組后,這些研究已經(jīng)恢復(fù)了對患者的入組。禮來預(yù)計2021年春季公布UC III期研究的誘導(dǎo)數(shù)據(jù)、2022年公布CD III期研究的頂線結(jié)果。(生物谷Bioon.com)



 110102000668(1)號
110102000668(1)號